【概要】
心房細動は心房内に350/minを超える電気的興奮が起こる病態.
65歳以上の高齢者に多く, 心不全・脳梗塞・認知症などの合併の危険因子となる.
発症因子:男性, 高血圧, 心不全, CAD, 心臓弁膜症, DM, 肥満, SAS, 高尿酸血症, 喫煙, 飲酒, 遺伝
<発生機序>
AFの電気生理学的機序は, 主に2つに分けられる.
1.トリガー(心房細動の引き金になる期外収縮)となる異常興奮(自動能/自動興奮)の発生
トリガーはエントリーの引き金であり, 洞結節以外の部位から発生する異所性の早期興奮と定義される.
約90%は肺静脈(PV)周囲に存在する肺静脈筋スリーブと呼ばれる心筋組織から生じる.
→その後, PV以外にも上大静脈(SVC), 冠静脈洞(CS), マーシャル静脈(靭帯), 下大静脈などの静脈系血管からAFのトリガーとなる期外収縮が発生することがわかっている.
→心房内のCFAE(complex fractionated atrial electrogram)と呼ばれる複雑電位は伝導遅延やリエントリー回路のピボットポイントおよび局所ドライバーの興奮を反映していると言われている.
肺静脈撃発活動による自動興奮が心房細動のトリガーとなり, 肺静脈と心房筋の境界領域がリエントリー回路を形成し心房細動が持続する(発作性心房細動の場合)
心房細動が発作性から持続性にかわるときは心房筋の電気的リモデリングによる心房不応期の短縮と周期長の短縮で説明される. 心房内の興奮旋回路の数により心房細動の持続が決定されるが, 興奮旋回路の長さが短いほど同時に存在する興奮旋回路の数が増し, 心房細動が持続する.
2.リエントリーが成立するための不整脈基質の形成(心房リモデリング)
器質的疾患, HT, DMなどの外的ストレス, 心房内炎症疾患, 心房細動自体が心房の構造的リモデリングを生じ, 筋束の間の電気的解離と局所伝導の不均一性を生じ, リエントリーをきたしやすくする. また, 心房リモデリングは心房内の凝固系亢進による血栓形成に働く(心房リモデリングによる心房収縮能低下および心房拡大で血流うっ滞を起こし, 特に左心耳内で血栓ができやすくなる)

【分類】
発作性(paroxysmal):7日以内に洞調律に戻る
持続性(persistent):7日以上持続する
長期持続性(long-standing persistent):1年以上持続するAFで, 洞調律維持を考慮し得るもの
永続性(permanent):洞調律にならない, 除細動不可能なもの

【検査】
<ECG>
f波はⅡ誘導ではなく, 右心房に近いV1誘導で記録されることが多い
未治療の心房細動ではQRSは150-200/minであることが多いが, 高齢では房室伝導が減少するため100/min以下になることが多い.
【薬物治療】
心房細動は以下の通りで治療を行っていく.
<心拍数調節(Rate Control)>
血行動態が安定している場合はHR 110 bpm以下を目標にする.
原疾患や背景因子(脱水, 貧血, 感染症, 電解質異常など)への介入を同時に行うと, 至適HRにコントロールされることが多い.
使用される薬物:β遮断薬, ジギタリス, 非ジヒドロピリジン系Ca拮抗薬, アミオダロン
第一選択薬はβ遮断薬(心筋の保護効果, 生命予後の改善などの付加価値があるため)
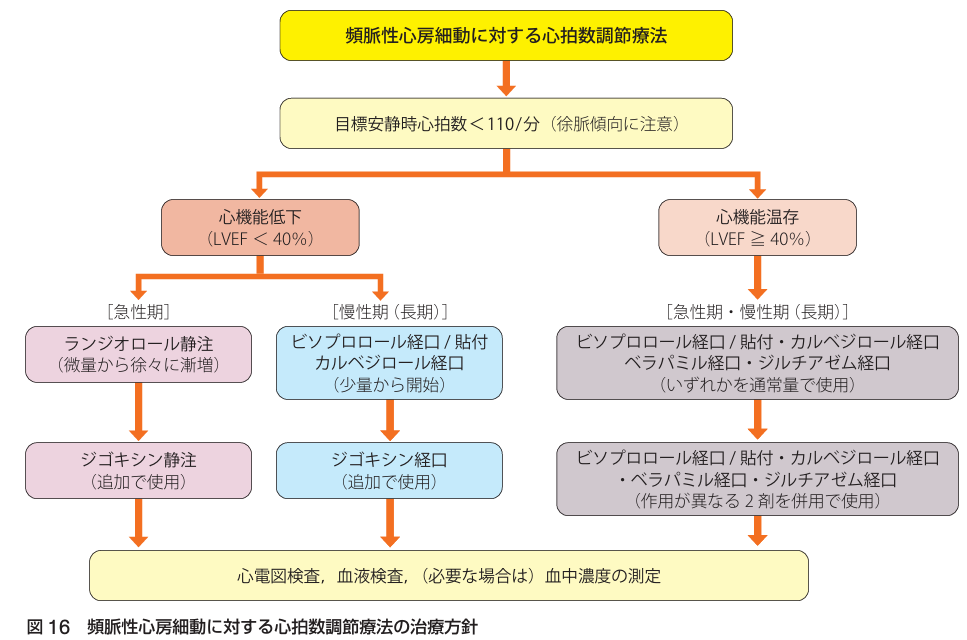
☆急性期
〇ランジオロール オノアクトⓇ
超短時間作用型β1遮断薬であり, HR抑制効果, 洞調律回復において優れている.
用量:オノアクトⓇ150mgを生食50mLに溶かし, 2γから開始し, 1-10γの間で調整(LVEFが低い場合は1γから開始)
※HFrEF(LVEF<40%)の頻脈性心房細動では非ジヒドロピリジン系Ca拮抗薬の静注薬は禁忌
〇ジゴキシン ジゴシンⓇ
急性心不全を伴う場合やβ遮断薬で効果不十分の場合に考慮. 長期投与は禁忌.
心アミロイドーシス, HOCMでは禁忌
用量:ジゴシンⓇ 1回0.25mg静注→高齢者は腎機能低下例も多く, 高用量はいかないほうがよい.
☆慢性期
■ビソプロロール メインテートⓇ/ビソノテープⓇ
カルベジロールと比較すると心臓選択性(β1作用)が強いため, 心拍数抑制効果が強い→高齢者では高度徐脈に注意
用量:メインテートⓇ 1回2.5mg 1日1回 効果不十分の場合は5mgまで増量可
ビソノテープⓇ 1回4mg 1日1回 効果不十分の場合は8mgまで増量可
■カルベジロール アーチストⓇ
用量:頻脈性心房細動→アーチストⓇ 1回5mg 1日1回 最大20mg
<洞調律維持(Rhythm control)>
●
<抗凝固療法>

※高血圧:BP≧140/90 mmHgまたはその既往
☆腎機能が正常~中等度腎機能障害のとき
DOACが推奨される.
生体弁も非弁膜症性に含まれるが, 術後3ヵ月間は洞調律であってもワルファリンが推奨されており, このときにDOACのエビデンスはない.
用量:リバーロキサバン イグザレルトⓇ 1回15mg 1日1回(CCr 15-49mL/minなら1回10mg)
アピキサバン エリキュースⓇ 1回5mg 1日2回(80歳以上, 体重60kg以下, Cr≧1.5mg/dLのうち2つ以上満たす場合は1回2.5mg)
エドキサバン リクシアナⓇ 1回30mg 1日1回 体重60kg以上では1回60mg(CCr 15-50mL/minでは1回30mg, 80歳以上で出血リスクの高い場合は1回15mgへ減量を考慮)
☆重度腎機能障害のとき
DOACはCCr≦15mL/minの場合は禁忌となり, 選択肢としてはワルファリンのみになる.
ただし, ワルファリンも腎機能障害を認める場合は薬剤排泄遅延による出血リスクの増大が懸念され, 原則禁忌になっている.
→重度腎機能障害の場合は, 使用に際して抗凝固薬投与の必要性を十分に検討する必要がある.
また, 維持透析中の患者のワーファリン投与も原則禁忌であるが, ABL周術期には使用することが多い.
用量:ワーファリンⓇ 初回1-5mgを投与し, 数日かけて目標値領域に調節していく

ワルファリンはPT-INR 1.6~2.6(弁膜症性:2.0~3.0)でコントロールし, PT-INRの定期的な確認を行い, TTR(PT-INRの目標達成率)>60%を目指す.
DOAC長期投与例では1年に1回は腎機能検査を行い, 処方用量が適切か再評価する.
・抗凝固療法中の出血リスクの評価にはHAS-BLEDスコアを用いる.
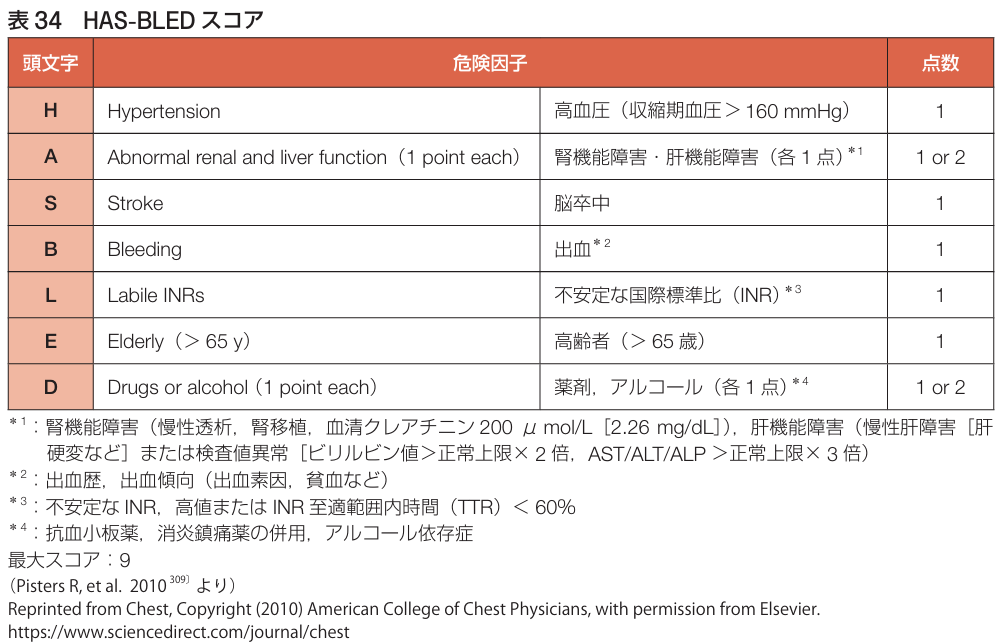
HAS-BLED≧3であれば出血リスクが高いと考えられる.
出血リスクの高い患者では定期的に血液検査を行う必要がある.
Cr:用量設定
肝機能検査(AST, ALTなど)
Hb:開始後1ヵ月以内に合併症を起こすことが多いため, 経時的に確認する.
凝固検査:特殊な病態(血友病、肝硬変、血液型O型など)による凝固系の過延長がないかを確認する.
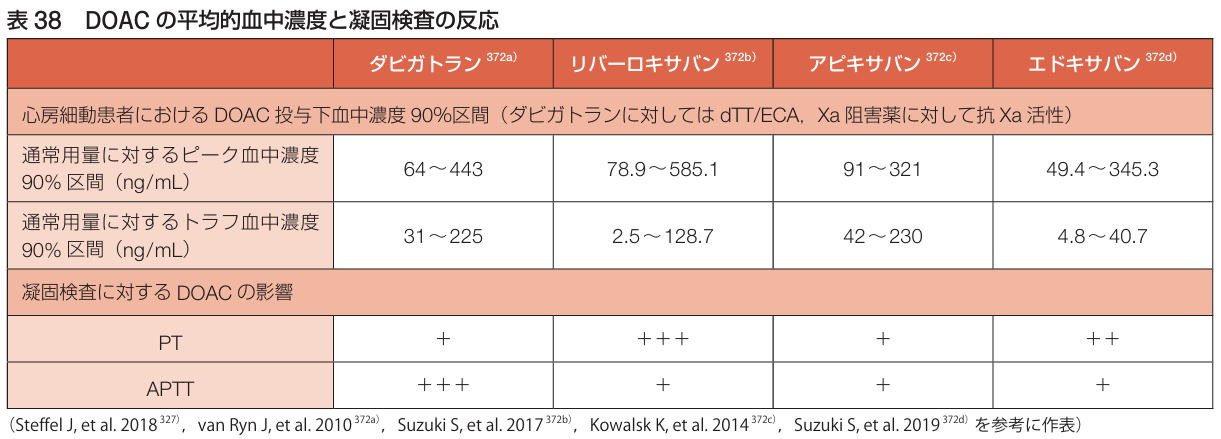
DOACにはon therapy range(血中濃度90%の至適血中濃度)があり, これを超えると出血リスクが高まる→開始1-3か月後に再検し, 直接トロンビン阻害薬ではHTI・APTT, 直接Xa阻害薬では抗Xa活性・PTで評価する.
※透析患者のワーファリン→原則禁忌(ABL周術期は使用)
~出血時の対応~

【除細動(カルディオバージョン)】

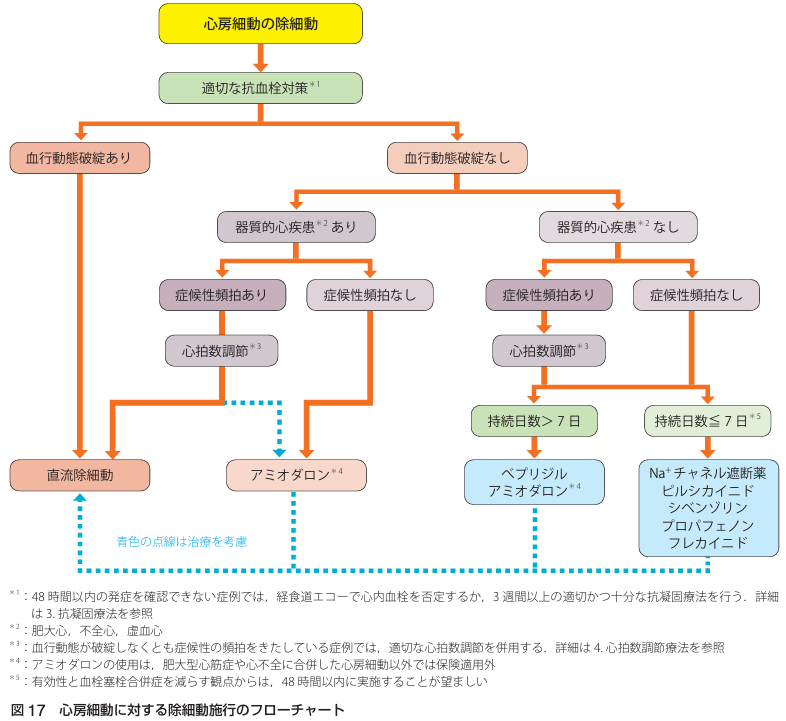
48時間以内のAFであればTEEでの血栓確認なしでカルディオバージョンOK
【アブレーション(ABL)】
<治療推奨レベル>
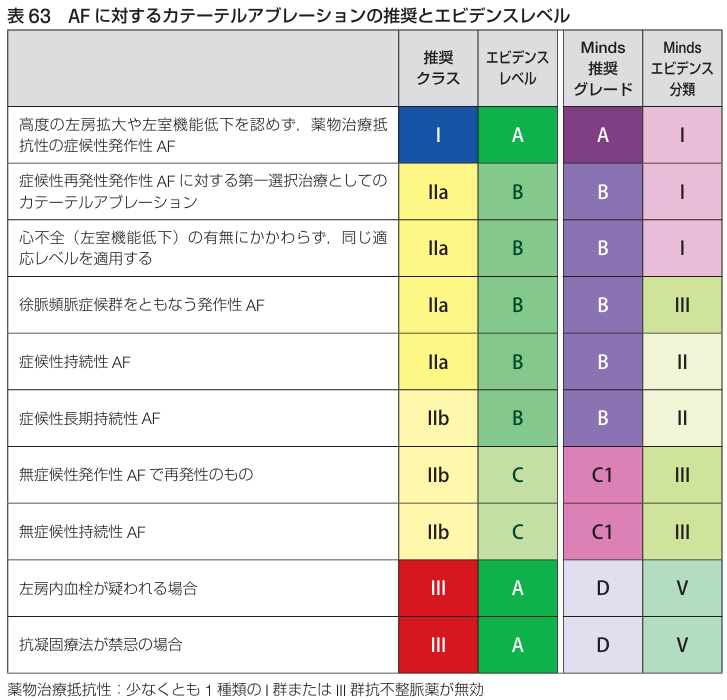
2024年のフォーカスアップデートでは適応の内容が追加されている.
〇症候性再発性のPAFに対する第一選択としてクライオバルーンを用いたカテーテルアブレーションを行う(ClassⅠ)
〇無症候性再発性のPAFでCHA2DS2-Vascスコア≧3の場合にカテーテルアブレーションを考慮する(ClassⅡa)
~心不全を伴う心房細動~
〇明らかな基礎心疾患がなく, 心房細動起因性のLVEF低下が疑われる心房細動患者に対して, カテーテルアブレーションを行う(ClassⅠ)
〇GDMTが行われているのにLVEFが低下している心房細動患者にカテーテルアブレーションを行う(ClassⅡa)
〇心不全の要因となる合併疾患のないHFpEFの心房細動患者にカテーテルアブレーションを行う(ClassⅡb)
<隔離方法>
☆肺静脈隔離術(PVI:Pulmonary vein isolation)
AFの多くが肺静脈を起源として発症するため, アブレーションでは最初に行われる.
個別肺静脈隔離術→4本のPVを個別に1本ずつ隔離する.
拡大同側肺静脈隔離術→LPVとRPVをそれぞれ隔離する.
BOX隔離術→肺静脈だけでなく左房後壁も一括して隔離する.
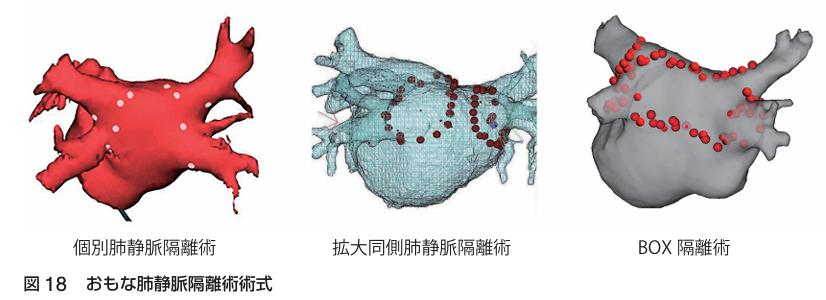
左房後壁も隔離することで, 後壁のトリガー, CFAE, 低電位領域も包囲でき, リエントリーもブロックできる.
Per AFでは隔離面積が大きいほど成功率が向上すると言われている.
☆心房内線状アブレーション
PVIで効果不十分な場合に行う.
・左房天蓋部ライン(roof line):両上肺静脈を結ぶところ
両上肺静脈が隔離されていることが前提である.
・左房後壁底部ライン(bottom line)
roof lineとセットで行うことで後壁隔離が完成する. 両下肺静脈間の線状アブレーション.
・僧帽弁輪峡部(mitral isthmus line)
左下肺静脈と僧帽弁輪峡部間の線状アブレーション.
カテーテルが当たりにくいこと, CSがあることにより成功率が低下しやすい.
☆CFAEアブレーション
異常心房電位に対するアブレーションである. 拡大肺静脈隔離などと組み合わせて使用することが推奨.
CFAEは低電位(≦0.15mV)で, 2つ以上の振れからなる分裂電位あるいは連続した基線の振れを示す電位, 非常に短い周期(<120ms)の心房電位
好発部位→PV, 心房中隔, 左房天蓋部, 左房後中隔弁輪部, CSos
<アブレーション後の合併症>
☆心房頻拍(AT)
アブレーション後に発生する機序は
①巣状興奮→多くがマイクロリエントリーによる局所での興奮旋回
②マイクロリエントリー→過去に焼灼またが隔離したPVの伝導ギャップを介した回路を旋回
※原因→不完全なPVI, 伝導ブロック作成に至っていない線状アブレーション, CFAEアブレーション
●対処法
Blanking period(ABL後3か月以内)→保存的加療(レートコントロール, 無理ならリズムコントロール, DC)
Blanking period後→再アブレーション
<周術期の抗凝固療法>
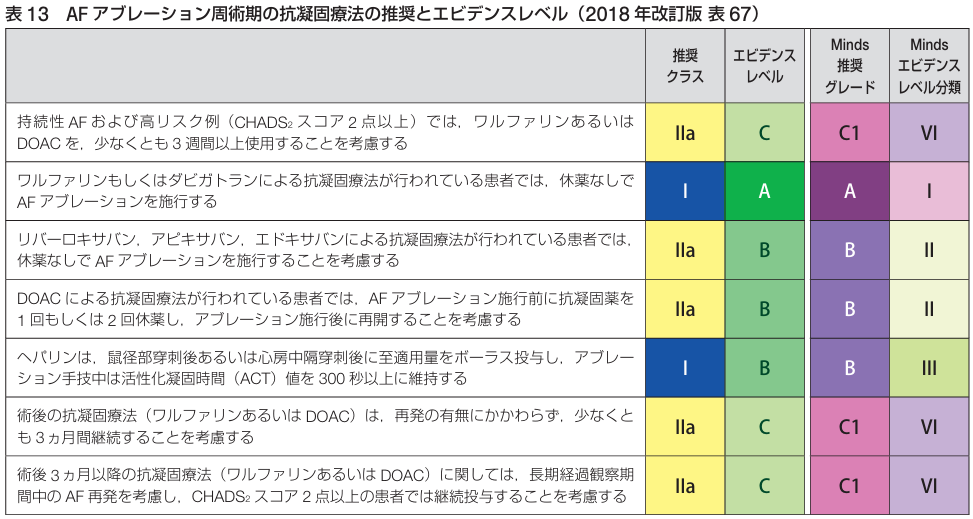
アブレーション入院日までは処方されていたDOACを継続する.
アブレーション入院時よりダビガトラン(プラザキサⓇ)もしくはワーファリンに変更する.
退院時は元のDOACに戻す(最低でも3か月は継続)
3ヶ月後洞調律維持→CHADS2スコア≧2ではDOAC継続, CHADS2スコア≦1では中止可能
【左心耳閉鎖術(LAAC)】
非弁膜症性心房細動(NVAF)に対する血栓塞栓症の予防が必要とされ, かつ長期的な抗凝固療法の代替が検討される症例に考慮してもよい(ClassⅡb)
☆適応
長期的な抗血栓療法が推奨される(CHADS2スコア≧2)
高出血リスク(HAS-BLEDスコア≧3, BARC type3の出血の既往, DAPTが1年以上必要, 転倒に伴う外傷に対して複数回治療を必要とした既往, びまん性脳アミロイド血管症の既往)
※BARC type3
3a:明らかな出血+Hbが3-5g/dl低下+ 輸血
3b:明らかな出血+Hbが5g/dl以上低下, 心タンポ, 外科治療が必要な出血, カテコラミンを要する出血
3c:頭蓋内出血, 視力の損傷を伴う眼内出血
【ポイント】
・無症候性のPAFではLAD<50mm, CHA2DS2-VAScスコア≧3点のときにリズムコントロールにより心不全入院, 脳梗塞, 心臓死を減らすことができた.
【参考文献】
●JCS 不整脈非薬物治療ガイドライン(2018)
●JCS フォーカスアップデート不整脈非薬物治療(2021)
●JCS 不整脈薬物治療ガイドライン(2020)
●JCS フォーカスアップデート不整脈治療(2024)




コメントを残す